科研进展丨通过精准组装整合素配体以控制细胞迁移的抑癌新方法
细胞迁移在从胚胎发育到肿瘤转移等多种生物现象中起着核心作用。整合素作为负责细胞粘附和迁移的主要细胞受体家族,长期以来一直是生物材料开发的主要靶点。
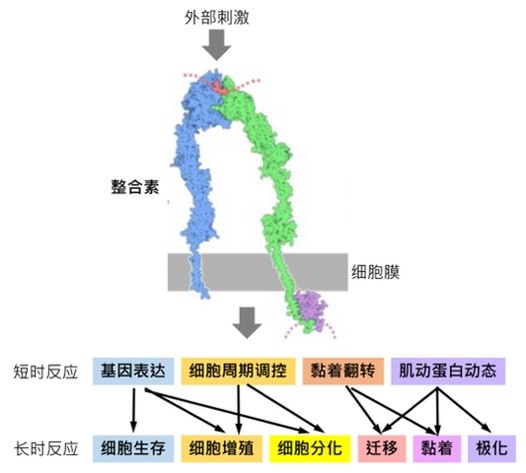
整合素(integrin)又称整联蛋白、接合蛋白,是一种介导细胞和其外环境之间的连接的跨膜受体,普遍存在于脊椎动物的细胞表面。作为细胞粘附分子家族的重要组成部分,整合素参与细胞增殖、分化、黏附和迁移等过程,在多种病理过程中发挥重要作用 (下图),作为生物医药以及生物材料开发的主要靶点,一直备受关注。
近年来,生物学在整合素介导的粘附机制的研究进展揭示了精确控制整合素配体的二维分布在控制细胞迁移中的重要性。纳米加工技术的发展增强了对整合素配体空间呈现的控制,促进了整合素介导的粘附机理的研究,从而激发了生物材料的创新。然而,自上而下的纳米器件制造技术在呈现整合素配体空间分布的分辨率局限,以及其技术本身的应用局限,限制了基础研究的进展以及整合素调控在生物医学上的应用。
为了打破现有局限,松山湖材料实验室智能软物质团队设计了一种自下而上的纳米制造策略,通过使用可用作药剂制备的多肽配方,结合多肽修饰、分子自组装,以及分子共组装等纳米材料制备技术,将整合素纳米材料的空间分辨率提高到分子水平(图1)。通过纳米生物界面相互作用差异化(图2),不仅实现了选择性的对靶向癌细胞迁移的双向精准调控(图3),并阐释了新型抑癌生物材料的设计策略以及其功能机制,为肿瘤转移治疗提供了新思路。
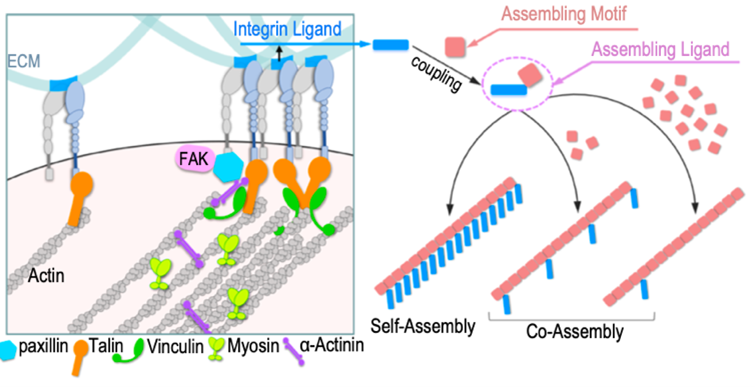
图1 通过多肽组装实现对整合素配体二维分布的精准调控的设计理念。
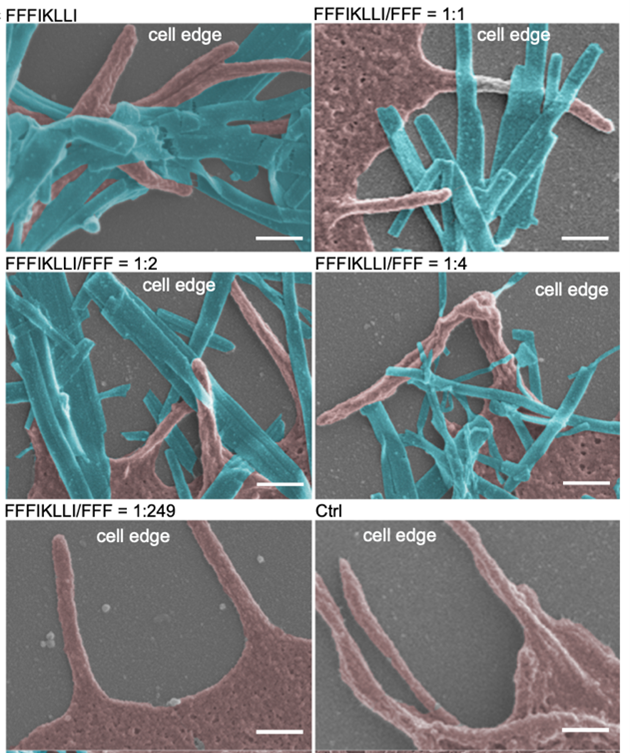
图2 扫描电镜下,具备不同整合素配体二维呈现的纳米材料(蓝色)与靶向肝癌细胞丝状伪足 (粉色)的亲和度体现。比例尺代表300纳米。
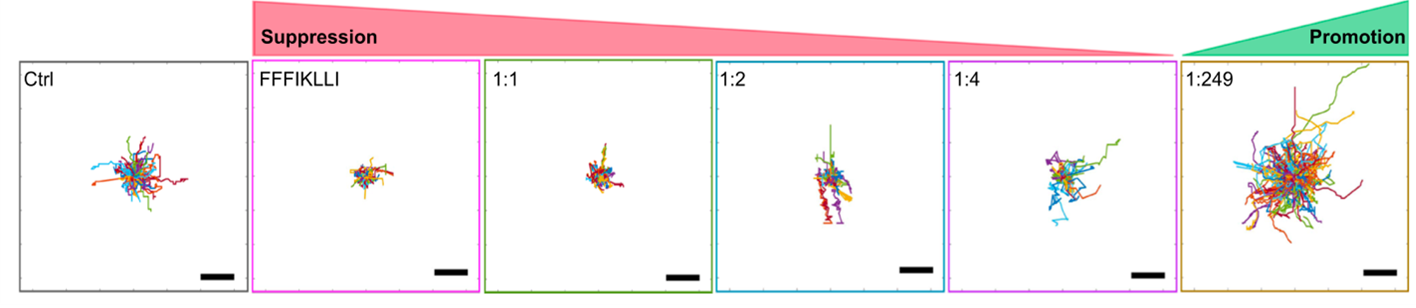
图3 在具备不同整合素配体二维呈现的纳米材料作用下肝癌细胞轨迹图。
相关研究成果发表在Nature Communications。助理研究员胡训武为论文第一作者,团队负责人张晔为通讯作者。松山湖材料实验室为第一通讯单位。
原文链接:https://doi.org/10.1038/s41467-022-32686-2

