科研进展丨利用顺序蛋白诱导的多肽共组装构建双相自适应性细胞外支架
在自然界中,干细胞的命运直接受到其与周围细胞外基质(ECM)相互作用的影响,其中机械信号和内在的生化因子共同作用,引发一系列空间和时间上协调的事件,调控细胞的分化和功能。生物源的天然ECM材料富含各种蛋白质和信号分子,为许多细胞培养和应用提供了生物学上真实的微环境。然而,这些材料成分的不明确和可变性,加上对物理或生化操作的有限响应能力,给精确调控以诱导期望的细胞行为和实现特定生物学结果带来了挑战。可以预见,设计合成支架以复制特定ECM的形态、力学和动态特性,提供在干细胞分化过程中严格控制的时空信号,将为组织重建的推进带来巨大希望。
在过去的二十年中,利用合成聚合物作为细胞外支架取得了重大进展。值得注意的是,支架的刚度、可降解性,以及细胞粘附肽和生长因子的结合等关键参数,在成分、分子量、交联剂类型、交联密度和聚合方法方面进行了系统调整。这些定制的聚合物材料提供了相对静态的微环境,促进了干细胞分化。然而,干细胞的分化涉及多个细胞过程的复杂相互作用,需要持续调整ECM以适应这些动态变化。最近,具有可调节交联密度的机械动态聚合物,通过光、化学成分、声波和可逆氢键等方式开发出来,以模拟重塑过程。然而,物理和化学地持续修改以适应一系列不同细胞过程仍然是一个艰巨的挑战。与其预先定义有利于细胞功能的初始参数,不如依赖细胞介导的过程动态优化材料特性,这可能是构建适应干细胞分化复杂性的支架的关键。
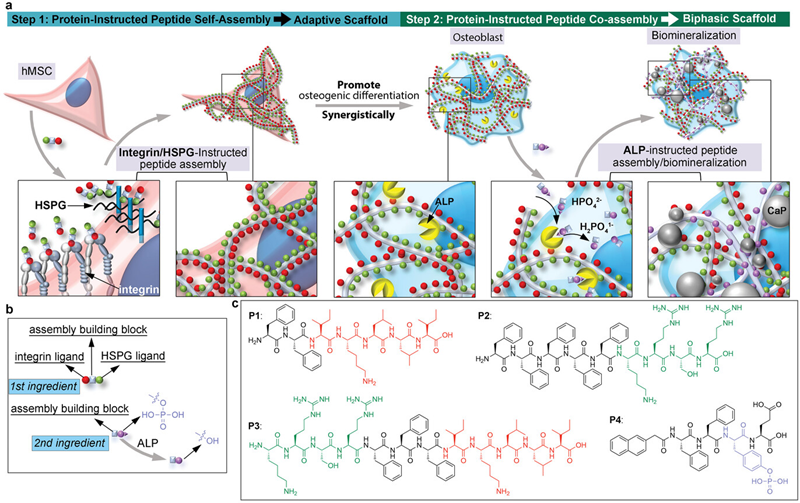
图一. 逐步构建用于hMSC成骨分化的自适应双相支架。a) 自适应双相支架的示意图,由hMSC组装并涵盖成骨分化过程。b) 两种用于顺序蛋白指导肽组装的肽的设计示意图。c) 本研究中应用的合成肽的化学结构。
为应对这一挑战,松山湖材料实验室的智能软物质团队提出了一个精心设计的细胞组装双相支架策略,结合人源间充质干细胞(hMSC)与合成支架在成骨分化过程中相互作用的全过程,通过顺序蛋白生物标志物诱导的多肽组装方法进行构建和重塑(图一)。该构建过程始于在干细胞分化初始阶段引入一种双靶向肽-选择性结合人源间充质干细胞(hMSC)上高表达的整合素和乙酰肝素硫酸蛋白聚糖(HSPGs)的组装多肽。这些多肽在整合素与HSPG诱导下原位组装,在干细胞表面形成定制版的细胞外支架,促进了hMSC的成骨分化。随着成骨细胞中碱性磷酸酶(ALP)和胶原蛋白(COL-1)表达的增加,引入了另一种在ALP催化下诱导组装的多肽,启动了两种多肽的共组装并促进了磷酸钙(CaP)的沉积。多肽组装形成的纳米纤维与胶原纤维的生长和缠绕有效地将CaP融入纤维网络,最终形成了一种自适应双相支架,增强了骨损伤的愈合。利用阶段特异性蛋白并采用原位分子组装的方法,确保了对不断变化的细胞微环境的定制化动态响应,这对于在整个分化过程中引导干细胞命运至关重要,持续反映自然组织发育中固有的复杂信号。通过附着在干细胞膜上,这些支架展示了在成骨分化过程中对不断变化的细胞类型的显著适应性,使其成为超越现有骨愈合方法和策略的优越候选者。
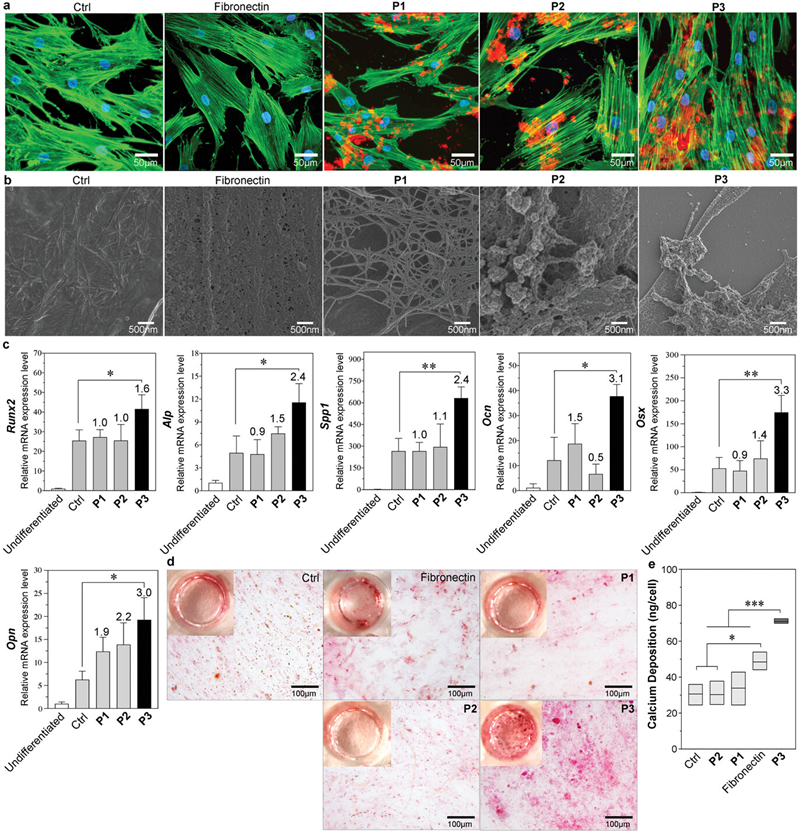
图二. 双靶向组装肽在hMSCs的顶膜上原位自组装,促进成骨分化
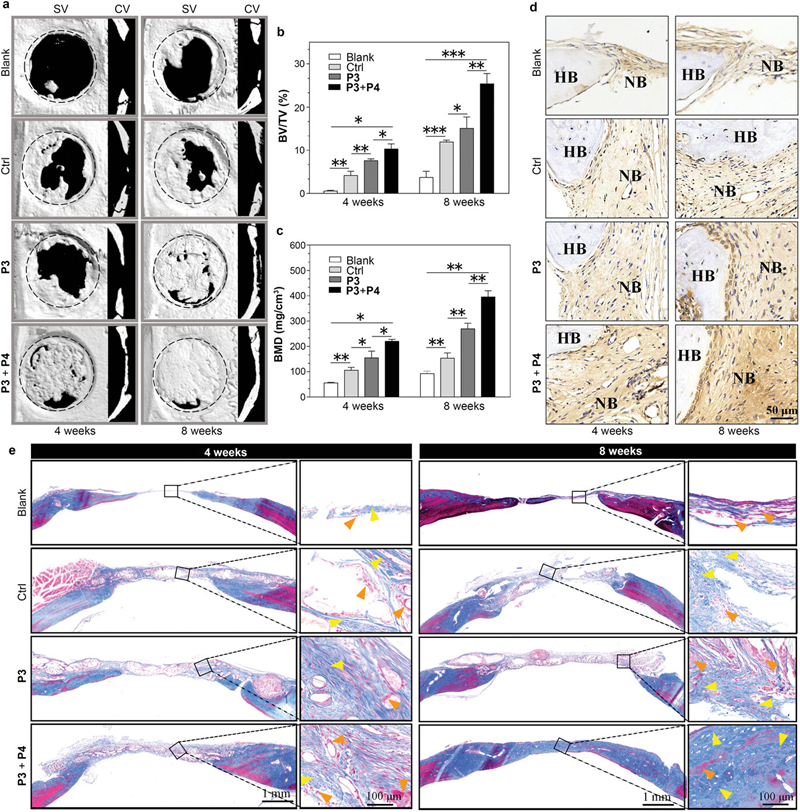
图三. 自适应性双相支架促进骨再生
相关研究成果发表在Advanced Science。团队负责人张晔为通讯作者。松山湖材料实验室为唯一通讯单位。合作单位包括郑州大学河南先进院,郑州大学第一附属医院,西安交通大学基础医学院,日本电子株式会社,以及日本东北大学综合材料研究所。
原文链接:
https://doi.org/10.1002/advs.202401478
