科研进展丨多价相互作用驱动的肽-核酸共组装及其免疫激活
慢性咽炎挥之不去,感冒后鼻子、咽喉、气管处引发的炎症总在“随机抽奖”?这些常见的慢性炎症,常常让我们陷入两难:不吃抗生素怕病情加重,吃了又担心培养出“超级细菌”。
面对这个困局,我们把目光投向了人体自身。一个有趣的发现是,我们体内存在一种叫“抗菌肽”(如LL37)的天然抗生素。在炎症部位,它大量聚集,却像一把双刃剑:既能高效杀菌,有时又能“火上浇油”,加剧炎症。
这把“双刃剑”是如何工作的?我们能否只取其利、不纳其弊?带着这些问题,我们模仿并改进了它的作用方式,成功开发出一种能够精准激活免疫的“抗菌肽-核酸自组装纳米材料”,为新一代免疫疗法和疫苗佐剂的设计提供了新思路。
这项工作由松山湖材料实验室纳米生物材料团队魏裕双副研究员、元冰研究员和苏州大学杨恺教授合作完成,近日发表在国际期刊Materials Today Bio上。

01 从随机混合到精准自组装:构筑可控的肽-核酸纳米复合物
在免疫学领域,CpG寡核苷酸(CpG ODN)作为一种模拟病原体DNA的分子,是公认的强效免疫佐剂,能通过Toll样受体9(TLR9)通路激活免疫细胞。然而,其单独使用时细胞摄取效率有限,限制了其生物学效能。研究团队发现,人体内的抗菌肽LL37能增强CpG的免疫刺激活性,但其背后的精细机制,尤其是在非晶态自组装层面,尚未被完全阐明。本研究揭示,带正电的LL37与带负电的CpG可通过多价静电相互作用,自发、快速地共组装成稳定的非晶态纳米颗粒(L/C NPs)。更重要的是,通过精确调控二者的电荷比(L/C ratio),可以精准地调控纳米颗粒的粒径(从约40 nm到250 nm)和表面Zeta电位(从-28 mV到+12 mV),实现了对纳米复合物物理化学性质的定制化设计。
02 激活多重内化通路:破解细胞屏障,实现高效递送
高效的细胞内化是免疫佐剂发挥作用的前提。研究发现,这种自组装策略从根本上改变了CpG的入胞方式。单独的CpG主要依赖于效率相对较低的网格蛋白介导的内吞作用进入细胞。而组装成L/C NPs后,其细胞内化过程被重塑,激活了两种更高效的“VIP通道”:受体介导的巨胞饮作用(receptor-mediated macropinocytosis)和LL37介导的膜穿透(membrane penetration)。这种多通路协同的内化机制,极大地提升了CpG的递送效率。定量分析显示,与单独使用CpG相比,共组装后的CpG细胞内摄取量提升了高达5.4倍,显著突破了传统递送方式的瓶颈。
03 协同增效:显著放大免疫应答,战斗力提升3.5倍
成功进入细胞后,L/C NPs被转运至溶酶体,其中的CpG分子与溶酶体内的TLR9受体有效结合,从而触发下游免疫信号级联反应。实验结果有力地证明了这种递送策略带来的巨大优势:在巨噬细胞模型中,经过L/C NPs处理的细胞,其关键炎症因子肿瘤坏死因子-α(TNF-α)的分泌水平,相较于等量CpG单独处理组,提升超过了3.5倍。这一结果清晰地表明,通过多价共组装策略,不仅解决了CpG的递送难题,更通过协同作用,将免疫系统的激活效率提升到了一个新的层级。
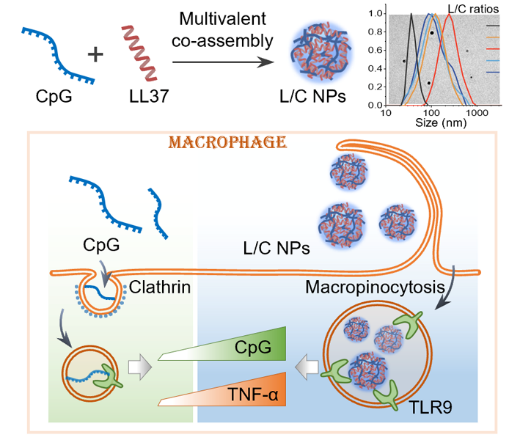
图1. 相较于纯CpG分子,自组装L/C纳米颗粒通过“巨胞饮”和“膜穿透”两种路径实现高效细胞内化,从而显著放大免疫应答
本研究系统地阐明了LL37增强CpG免疫活性的新机制:即通过电荷比调控的自组装形成纳米结构,并激活多种细胞内化途径,从而实现CpG的高效递送和免疫应答的显著增强。这一发现不仅加深了对抗菌肽-核酸相互作用及其生物学功能的理解,更为理性设计新一代疫苗佐剂和免疫调节药物提供了全新的、可控的纳米技术平台。未来,这种策略有望应用于开发更高效、更安全的疫苗和针对慢性炎症、自身免疫病乃至肿瘤的免疫疗法,展现出巨大的临床转化潜力。
文章链接
https://doi.org/10.1016/j.mtbio.2025.102011
