科研进展丨形状之择,熵力之舞:揭示纳米颗粒协同“伴吞效应”中的几何选择性与物理新机制
如何将治疗性分子精准高效地递送至细胞内部,是现代纳米医学领域的核心科学问题。一个长期以来被广泛接受的观点是:纳米载体与细胞膜的结合能越强(即热力学越稳定),其被细胞内吞的效率就越高。而在另一方面,当前纳米医学的发展促使研究人员们致力于多组分纳米递送系统的构建,期望能将多种药物精准地输送至同一个病灶细胞内,实现“1+1>2”的治疗效果。然而,当多个纳米颗粒在细胞表面发生协同相互作用时,这一基于“单体作用”的热力学法则是否依然适用?
近年来,松山湖材料实验室纳米生物材料团队与合作者发现并系统研究了一种被称为“伴吞效应”(Bystander Uptake)的协同内吞现象:即一类经过特殊功能化修饰的“主动”纳米颗粒(F-NPs)在进入细胞时,能够“携带”周围未经任何修饰的“旁观者”纳米颗粒(B-NPs)一同进入。这一发现为多组分药物的协同递送提供了全新的策略。在前期工作中,研究人员们已系统揭示了“伴吞效应”受颗粒尺寸、膜曲率以及自由能等多重因素的调控(Nat. Commun. 2019; Nanoscale 2021; ACS Nano 2022)。然而,一个更为关键且悬而未决的问题是:“旁观者”纳米颗粒的几何形状是否会影响其被“携带”的效率?是否存在一种最优几何构型?
针对这一问题,松山湖材料实验室魏裕双副研究员、元冰研究员与苏州大学杨恺教授、美国明尼苏达大学庞宏博教授等团队成员再度合作,通过实验、模拟与理论相结合的多学科交叉研究,系统揭示了“旁观者”纳米颗粒的形状选择性,并阐明了其背后由熵力主导的全新物理机制。相关成果以“Shape-Dependent Entropic Forces Governs Synergistic Bystander Nanoparticle Uptake”为题,近日发表于国际顶级期刊 ACS Nano 上。

黄金比例:纳米棒(长宽比3)的最优内化效率
研究团队首先通过化学合成,制备了一系列尺寸相近但几何形状迥异的“旁观者”纳米颗粒,包括球形、三角片、圆片状以及不同长宽比(Aspect Ratio, AR)的棒状颗粒。通过高分辨活细胞成像与高精度元素分析,团队系统比较了这些不同形状的颗粒在“主动”颗粒引导下的入胞效率。
实验结果清晰地揭示了显著的形状选择性:各向异性的纳米颗粒(如纳米棒、三角片)的“伴吞”效率远高于各向同性的纳米球。更令人意外的是,在所有测试的形状中,长宽比(AR)约为3的纳米棒表现出最优的协同内吞效率,成为了协同递送中的“冠军构型”。这一“黄金比例”的发现,首次证明了在协同内吞过程中,几何形状不仅重要,而且存在一个非单调的“最佳点”。
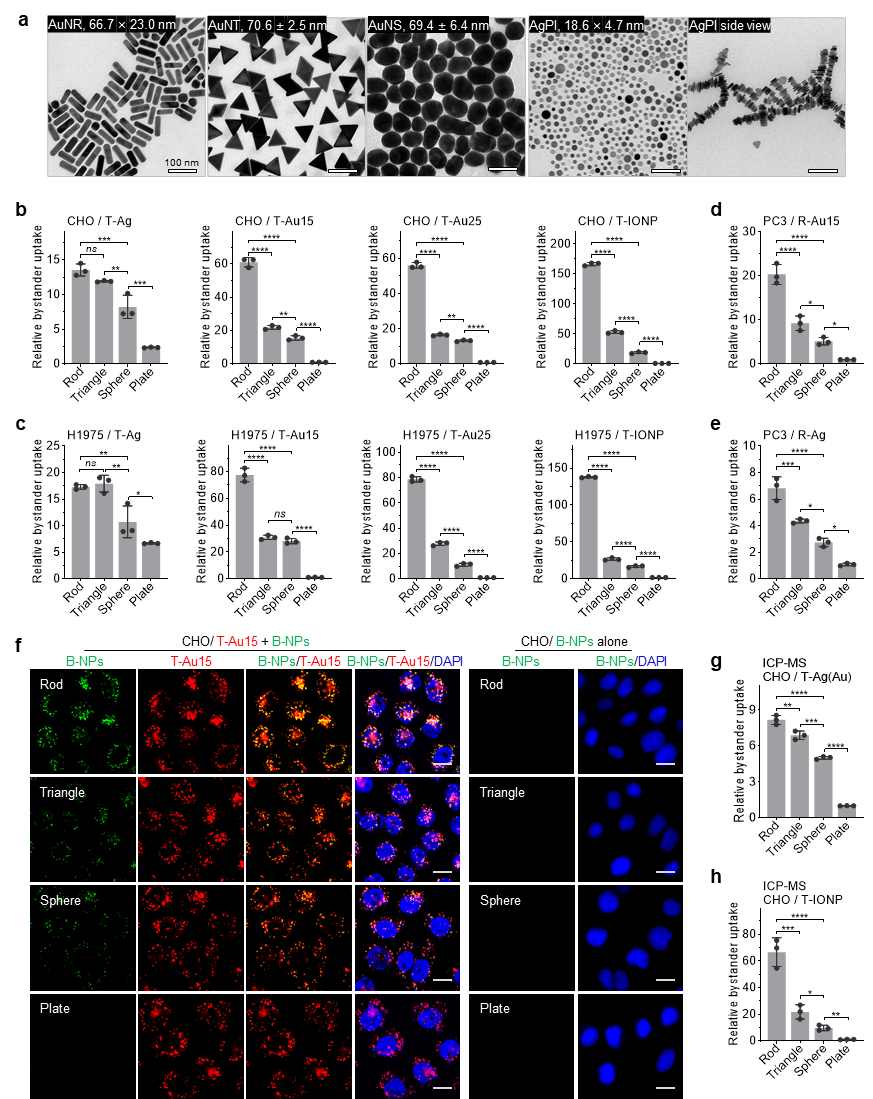
图1. 不同几何形状的“旁观者”纳米颗粒(B-NPs)协同内吞效率比较图。长宽比约为3的纳米棒(rod)表现出最优的摄取效率。
机制解析:从“终点稳定”到“路径择优”的范式转变
为何长宽比为3的纳米棒效率最高?传统观点通常认为,最强的结合对应着最高的摄取效率。然而,团队通过大规模分子动力学模拟发现,最优构型的摄取效率提升并非源于更强的最终结合亲和力。
模拟结果揭示了一个全新的物理机制:当“主动”颗粒在细胞膜上诱导形成内吞凹陷时,这个动态弯曲的膜口袋为进入其中的“旁观者”纳米棒提供了一个独特的微环境。纳米棒在此环境中并非被动地被包裹,而是会发生快速的自发取向重排。这一重排过程增加了其自身的运动自由度,从而在热力学上获得了熵增益。这种由形状决定的熵驱动力,使得纳米棒能够更快地穿越内吞过程中的能垒,被“捕获”在高效的中间态(metastable trapping),从而极大地加速了其最终的内吞进程。
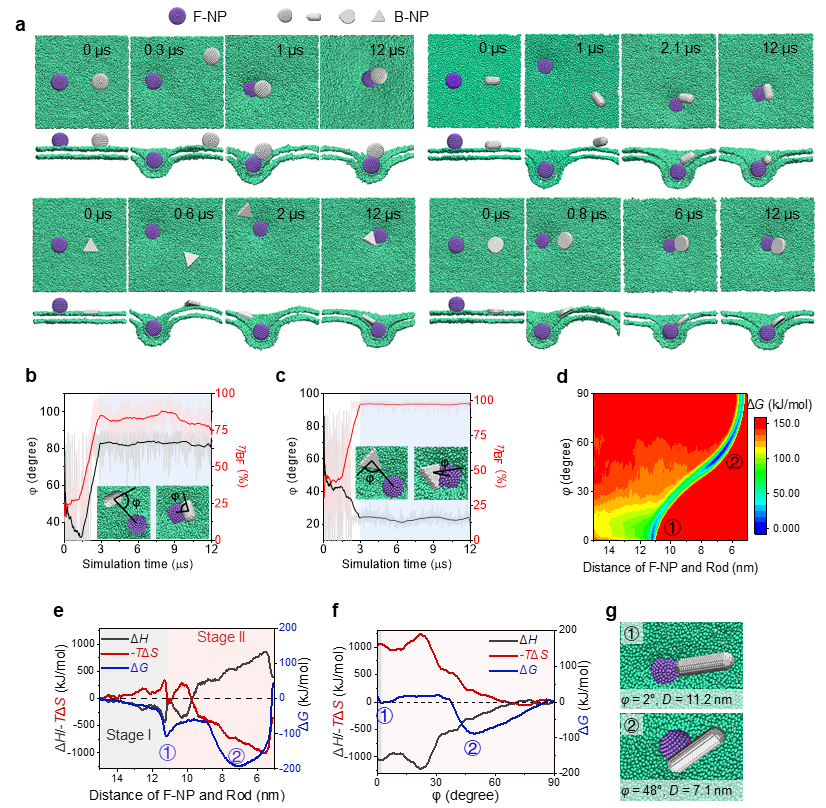
图2. 熵驱动的形状选择机制。纳米棒(Rod)的协同内吞过程存在由熵(-TΔS)主导的中间态,使其能够通过更优的动力学路径实现高效内吞,而非仅仅追求最低的能量终态。
进一步,团队通过构建理论模型,成功预测了长宽比约为3是平衡“熵增益”与“转动约束”的最佳“甜蜜点”(sweet spot)。纳米棒太短,熵增益不明显;太长,则自身转动过于缓慢,难以在膜包裹的“窗口期”内完成姿态调整而被“卡住”。这一理论完美地解释了实验观测到的现象,并强调了“协同效应”在这一过程中的决定性作用。
研究意义与展望
本项研究系统阐明了纳米颗粒协同内化过程中的几何选择性,并首次揭示了其背后由形状依赖的熵力所主导的动力学择优机制。这一发现具有重要的理论意义和应用价值:
首先,它为多组分纳米药物的理性设计提供了全新的指导原则,将设计范式从传统的优化结合亲和力(焓驱动),转向了对动力学路径和熵驱动中间态的工程化设计。这相当于从关注“终点”转向了优化“路径”,为开发更智能、更高效的协同递送系统开辟了新思路。
其次,该研究深化了对纳米-生物界面相互作用中基本物理规律的认知。它暗示了纳米颗粒并非被动的“物质”,而是能够响应并处理环境“信息”(如膜曲率)的智能实体。熵驱动的内吞过程,正是纳米颗粒对物理信息进行处理并做出最优路径选择的物理体现。
未来,团队将进一步探索这一新机制在更复杂的软物质纳米载体(如脂质体、聚合物胶束)以及真实生理环境中的普适性,旨在为肿瘤多药耐药性、联合免疫治疗等医学挑战提供创新的解决方案。
文章链接
https://pubs.acs.org/doi/full/10.1021/acsnano.5c13968
